沸点熔点的变化规律
氢化物的沸点与熔点的递变规律。
氢化物的沸点与熔点递变规律通常与元素的位置有关。在同主族元素中,从上到下,随着原子序数的增加,沸点和熔点一般逐渐升高。这是由于原子半径的增加导致分子间作用力的减弱,从而需要更多的能量来克服这些作用力,使分子从固态或液态转变为气态。然而,在同一周期中,从左到右,随着原子序数的增加,沸点和熔点一般逐渐降低。
没有必然联系,一般非金属的熔沸点依次递增,F,Cl,Br,l均属于非金属,满足这个规律。金属一般相反半径越大熔沸点越小。元素周期表的第五主族就是一个很好的列子,上面三个非金属熔沸点依次增大,后面2个金属熔沸点却在降低。
同周期比较的话,是从左至右熔沸点依次升高,因为气态氢化物的热稳定性是这样递变的。另外有时还要注意物质的类型,比如让你比较金刚石、钙、氯化氢的熔沸点,只要知道金刚石是原子晶体,熔沸点最高,其次是金属钙,最后是分子晶体氯化氢。
这些递变规律在一定程度上是适用的,但也存在一些特例。例如,氢键对熔沸点的影响不可忽视。例如,在HF和H2O这两种氢化物中,氢键的影响使得它们的熔沸点高于预期。值得注意的是,氢键的存在会显著提升某些氢化物的熔沸点,即使它们的分子间作用力相对较小。
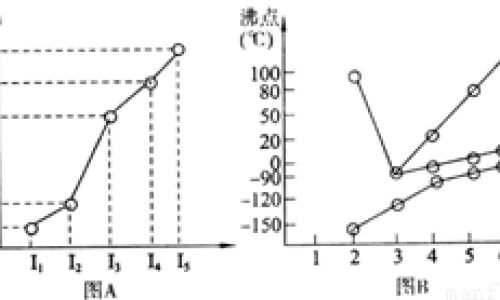
第ⅥA族氧(O)、硫(S)、硒(Se)、碲(Te)的氢化物的沸点递变规律,由H2Te,H2Se到H2S,随分子量的递减,分子的半径递减;随分子间作用力的减小,沸点递减。但分子量最小的H2O的沸点却陡然升高。这是因为氧的电负性很强,H2O分子间形成了O-H…O氢键,所以H2O分子间作用力大于同族其他氢化物。
半径小,金属键能大,就可以知道:从上到下,熔沸点降低。而第七主族的卤素,属于分子晶体所以看分子作用力大小,分子构成相同的情况下,分子相对质量越大分子间作用力越大,所以卤素从上到下熔沸点依次升高。
沸点熔点的变化规律
1、第一,分子晶体熔、沸点的变化规律:分子构型相同的物质,相对分子质量越大,熔、沸点越高。分子构型相同的物质,能形成氢键时,熔、沸点升高。相对分子质量相近时,分子的极性越强,熔、沸点越高。
2、沸点熔点的变化规律如下:分子晶体:相对分子质量的影响:分子构型相同的物质,相对分子质量越大,分子间的相互作用力越强,因此熔、沸点越高。氢键的影响:分子构型相同的物质,如果能形成氢键,会显著增加分子间的相互作用力,从而提高熔、沸点。
3、同一主族元素,从上到下,金属单质的熔沸点逐渐升高;(2)同一周期元素,从左到右,非金属单质的熔沸点逐渐升高。
4、熔沸点变化规律: 同主族元素: 金属单质:从上到下,沸点逐渐减小。这是因为随着原子序数的增加,金属原子间的金属键逐渐减弱,导致沸点降低。 非金属单质:从上到下,熔沸点逐渐增大。这通常与非金属原子间的共价键强度以及分子间作用力的变化有关。
5、有机物的熔沸点变化规律如下:相对分子质量的影响:一般来说,相对分子质量越大,分子间的范德华力越强,因此熔沸点越高。同系物的影响:对于同系物,随着碳原子数的增加,分子间的相互作用力增强,熔沸点升高。
有机物的熔沸点有什么变化规律
1、有机物的熔沸点变化规律如下: 相对分子质量的影响:一般来说,有机物的相对分子质量越大,其分子间的相互作用力(如范德华力)越强,因此需要更高的温度才能破坏这些相互作用力,使有机物从固态变为液态或气态。因此,相对分子质量越大的有机物,其熔沸点通常越高。
2、有机物的熔沸点变化规律如下:相对分子质量的影响:一般来说,相对分子质量越大,分子间的范德华力越强,因此熔沸点越高。同系物的影响:对于同系物,随着碳原子数的增加,分子间的相互作用力增强,熔沸点升高。
3、规律如下:一般来说,相对分子质量的越大,熔沸点越高;同系物:随着碳原子数的增加,熔沸点升高;同分异构体:支链越多,熔沸点越低;极性高的比极性低的熔沸点高;极性相近的,分子量大的熔沸点高;结构、极性、分子量接近的,分子间形成氢键的比分子内形成氢键的熔沸点高。
4、判断有机物熔沸点高低的规律主要有以下几点:氢键的影响:含有氢键的有机物熔沸点较高。特别是与氮或氧相连的氢原子所形成的化合物,由于分子间存在氢键,显著增加了分子间的吸引力,从而提高熔沸点。相对分子质量的影响:相对分子质量越大,熔沸点越高。
碱金属的熔沸点变化规律
1、碱金属的熔点和沸点从锂到钫逐渐降低。在元素周期表中,碱金属包括锂、钠、钾、铷、铯和钫(放射性元素)。随着原子量增大,金属原子之间的结合力减弱,导致熔沸点呈现规律性下降。例如,锂的熔点约为180°C,而铯的熔点仅有28°C。
2、碱金属一般熔点较低,随原子序数增加熔沸点降低。与水反应时,由于熔点低,碱金属大多会熔化成小球。碱金属的熔点、沸点随原子序数增加而降低,因而碱土金属的熔点沸点也会具有这变化规律。
3、碱金属从上往下金属性增强,单质还原性增强,熔沸点降低,密度增大。卤族从上往下非金属性减弱,单质氧化性减弱,熔沸点升高,密度增大。元素金属性强的的单质还原性强,阳离子氧化性弱。元素非金属性强的则相反。碱金属均有一个属于s轨道的最外层电子,因此这一族属于元素周期表的s区。
4、碱金属一族的熔沸点在这一列元素中随原子序数的增加而降低。
水加盐后沸点和熔点会有什么变化?
1、熔点(准确地说应该是凝固点)降低,沸点升高。这是因为稀溶液表现出依数性:溶剂的蒸汽压下降导致凝固点降低,沸点升高。这一现象仅适用于理想稀溶液,对实际稀溶液近似适用。在水中加入盐分,可以看作是理想稀溶液的近似情况。 沸点升高的原理:液体的蒸气压等于外界压力时的温度称为该液体的沸点。
2、在水中加盐会使水的沸点升高,而对熔点的影响较小,通常可以忽略不计。沸点升高的原因: 离子与水分子间的相互作用:加入水中的盐会电离成阴离子和阳离子。这些离子会与水分子中带相反电荷的部分相吸引,从而增大了液态水中分子间的作用力。
3、熔点(准确地说应该是凝固点)降低,沸点升高。原理是稀溶液的依数性:稀溶液中溶剂的蒸汽压下降,凝固点降低,沸点升高,渗透压的数值仅与一定量溶液中溶质的质点数有关而与溶质的本身性质无关。只适用于理想稀溶液,对稀溶液近似适用。在水中加盐可近似的看成是理想稀溶液。
4、随着盐不断溶解,溶液的性质会发生变化。溶液的密度会逐渐增大,相比于纯水,盐水的密度更高。这是因为盐的加入增加了溶液的质量,而体积变化相对较小。溶液的沸点也会升高,在标准大气压下,纯水的沸点是100℃,但加入盐后,盐水的沸点会高于100℃。

